groupe 3 : Biologie intégrative de la neurorégénération
Présentation
Nous étudions les mécanismes moléculaires qui sous-tendent les processus de neurodégénérescence et neurorégénération dans le cadre de pathologies médullaire, en particulier les lésions de la moelle épinière (LME). Les LME ne bénéficient d’aucune thérapie induisant une récupération même partielle. L'absence de récupération fonctionnelle résulte de l'absence de régénération axonale et est entre autre attribuée à la formation d'une cicatrice gliale, principalement composée d'astrocytes et de microglies, qui forme une barrière physico-chimique. Cependant, les cellules gliales jouent parallèlement des rôles bénéfiques sur la repousse axonale.
Nous développons une approche multimodale dans le but d'améliorer la régénération axonale après une LME.
Notre premier axe de recherche est de développer une analyse génomique intégrative cellule-spécifique afin d’identifier les gènes responsables du double rôle des cellules gliales après une LME. Une fois identifié, nous modulons l'expression de ces gènes spécifiquement dans les cellules gliales dans le but de renforcer leurs rôles bénéfiques et réduire leurs impacts négatifs sur la régénération axonale.
Le deuxième axe de recherche dans le laboratoire est de développer des outils de translation à la clinique. En parallèle de l’étude l'activité motrice de nos animaux lésés médullaires, nous développons l'utilisation de l'Imagerie par Résonance Magnétique (IRM). En effet, l'IRM est une méthode non invasive qui permet le suivi longitudinal des altérations anatomiques et structurelles induites par une blessure médullaire, de plus, c’est la seule méthode utilisée en clinique pour le lésés médullaires. Ce projet est développé en collaboration avec la plateforme BioNanoNMRI à l'Université de Montpellier qui a un appareil IRM 9.4T conçu pour les petits animaux.
Enfin, nous appliquons une analyse histologique afin de corréler les altérations moléculaires, cellulaires, et des tissulaires avec la récupération fonctionnelle.
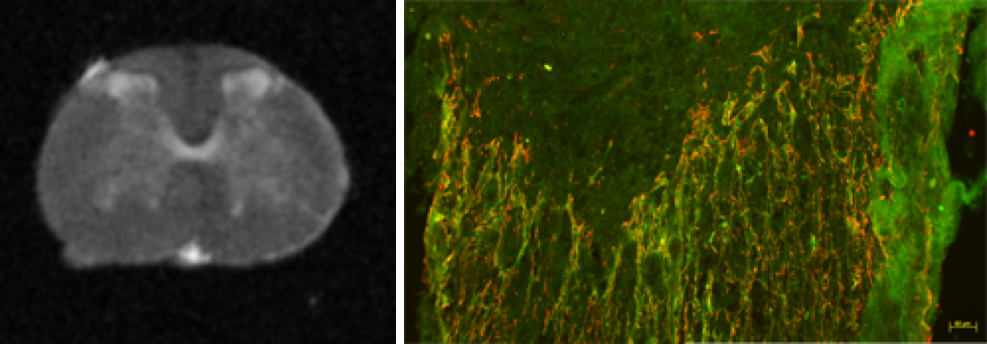
Légendes
Gauche : Image IRM ex vivo d’une moelle épinière non lésée.
Droite : Cicatrice gliale formée après une lésion médullaire. En vert, les astrocytes et en rouge les microglies.
Équipe
Florence Perrin, chef d'équipe
 |
Professeur, Université de Montpellier Membre de l'Institut Universitaire de France Contact : florence.perrin(at)umontpellier.fr |
Nicolas Lonjon
 |
PUPH Contact : n-lonjon(at)chu-montpellier.fr |
Gaétan Poulen
 |
Clinicien Attaché, PHU Contact : g-poulen(at)chu-montpellier.fr |
Yannick Gerber
 |
Post-doctorant, Université de Montpellier Contact : yannick.gerber(at)ibn-lab.com |
Chloé Gazard
 |
Doctorante Contact : chloe.gazard(at)umontpellier.fr |
Références
- Gerber YN, Sabourin JC, Rabano M, Vivanco M, Perrin FE (2012). Early functional deficit and microglial disturbances in a mouse model of amyotrophic lateral sclerosis. PloS One. 7(4): e36000.
- Gerber YN, Privat A, Perrin FE (2013). Gacyclidine improves the survival and reduces motor deficits in a mouse model of amyotrophic lateral sclerosis. Frontiers in Cellular Neurosciences. (7):280.
- Desclaux M, Perrin F, Do-Thi A, Prieto-Cappellini M, Gimenez y Ribotta M, Mallet J, Privat A (2015). Lentiviral-mediated silencing of GFAP and vimentin in reactive astrocytes improves functional recovery and axonal plasticity after spinal cord injury. Journal of Neuroscience Research. 93(1):43-55.
- Noristani* HN, Lonjon* N, Cardoso M, Le Corre M, Chan Seng E, Captier G, Privat A, Coillot C, Goze-Bac$ C, Perrin$ FE (2015). Correlation of in vivo and ex vivo 1H-MRI with histology in two severities of mouse spinal cord injury. Frontiers in Neuroanatomy, doi: 10.3389/fnana.2015.00024.
- Noristani* HN, Sabourin* JC, Gerber YN, Teigell M, Sommacal A, Vivanco M, Webber M, Perrin FE (2015). Brca1 is expressed in human microglia and is dysregulated in human and animal model of ALS. Molecular Neurodegeneration, 10:34, doi:10.1186/s13024-015-0023-x.
