Plateforme phenotypage comportemental souris (CompAn)
Page en construction
Page en construction
Le microcèbe (Microcebus murinus, Cheirogaleidae) est un animal modèle pour les études sur les primates. Le microcèbe est un lémurien nocturne de petite taille (60g à 100g), à la base de la lignée des primates. Son élevage en captivité est aisé grâce à une fécondité élevée (1-3 jeunes par an). Sa longévité en captivité (7-12 ans) permet des recherches expérimentales longitudinales notamment sur les processus de vieillissement. La colonie comprend une centaine d’animaux. Toutes les classes d’âge sont représentées.
Les démarches légales obligatoires pour la mise en conformité des personnes et des locaux ont été faites auprès des services vétérinaires et ministériels compétents : agrément des locaux, certificat de capacité d'élevage pour chercheur et zootechnicien, autorisation réglementaire d'expérimentation animale pour les chercheurs et 3 zootechniciens ayant les niveaux requis d'expérimentation animale.
Deux types de cages sont utilisées pour héberger les microcèbes :
- D'une part des volières (L=0,70m ; l=0,60m ; H=1,80m) fabriquées en acier inoxydable, avec un maillage de 1cm sur 1cm adapté à la physiologie et au déplacement des microcèbes (notamment le saut).

- d’autre part des grandes cages ( L=0,60m ; l=0,60m ; H=0,60m) posées sur structures métalliques destinées à accueillir deux animaux ou des mères avec leurs petits.

La saison de reproduction est sous influence du régime photopériodique. L’alternance sur l’année d’une phase d’activité (jours longs = été = période de reproduction) et d’une phase de repos complet (jours courts = hiver = pas de reproduction) est une caractéristique essentielle de ce primate. Le microcèbe est mature sexuellement à 8 mois. Les microcèbes restent sexuellement actifs et fertiles tout au long de leur vie, même à des âges très avancés (10 ans). Le succès reproducteur de la femelle croit avec l’âge (accroissement de la taille des portées et amélioration de la survie des jeunes). Les animaux hors période de reproduction sont regroupés par sexe et par poids similaire. On a donc des cages « unisexe » avec 2 à 5 individus.

Le régime alimentaire est le même en période de repos sexuel qu’en période de reproduction. La ration alimentaire (bouillie et fruits) est adaptée à chaque individu.
Nous assurons la formation des élèves de Lycées professionnels préparant au métier de technicien en expérimentation animale. Par ailleurs tous les utilisateurs sont formés aux bonnes pratiques d’utilisation du modèle (zootechnie, expérimentation, législation).
Cette plateforme accessible en collaboration a permis de développer des projets sur :
L’équipe
N Mestre Frances, DE1 EPHE, capacitaire, responsable scientifique de l’élevage
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
J Cuoq, Technicien EPHE, capacitaire, responsable technique de l’élevage
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
F Hugon, Adjoint technique EPHE, zootechnie
L Renancio, Adjoint technique CDD EPHE, zootechnie
Références
Mestre-Francés N., Serratrice N., Gennetier A., Devau G., Cobo S., Trouche S., Fontes P., Zussy C., De Deurwaerdere P., Salinas S., Mennechet F.J.D., Dusonchet J., Schneider B. L., Saggio I., Kalatzis V., Luquin-Piudo M.R., Verdier J.M, Kremer E.J. (2018) Exogenous LRRK2G2019S induces parkinsonian-like pathology in a nonhuman primate . JCI Insight 2018 3(14):e98202
Schmidtke D, Zimmermann E., Trouche S.G., Fontes, P., Verdier J.M., Mestre-Francés N. (2020) Linking cognition to age and amyloid –β burden in the brain of a non-human primate (Microcebus murinus). Neurobiology of aging 2020 Oct;94:207-216
Poulen G, Aloy E, Bringuier CM, Mestre-Francés N, Artus EVF, Cardoso M, Perez JC, Goze-Bac C, Boukhaddaoui H, Lonjon N, Gerber YN, Perrin FE. (2021) Inhibiting microglia proliferation after spinal cord injury improves recovery in mice and nonhuman primates. Theranostics. 2021 Jul 31;11(18):8640-8659.
DiFrancesco ML, Marrot M, Torre E, Mesirca P, Davaze R, Lautier C, Fontes P, Cuoq J, Fernandez A, Lamb N, Pifferi F, Mestre-Francés N, Mangoni ME, Torrente AG. (2023) Characterization of sinoatrial automaticity in Microcebus murinus to study the effect of aging on cardiac activity and the correlation with longevity. Sci Rep. 2023 Feb 21;13(1):3054.
Trouche SG, Boutajangout A, Asuni A, Fontés P, Sigurdsson EM, Verdier JM, Mestre-Francés N (2023). Amyloid-β targeting immunisation in aged non-human primate (Microcebus murinus). Brain Behav Immun. 2022 Dec 30;109:63-77

La plateforme poisson-zèbre ZEFIX - ZeNeuro au sein du laboratoire MMDN permet de développer de nouveaux modèles in vivo afin de comprendre les processus de dégénérescence neuronale.
Nous avons établi une expertise dans le développement et l’analyse du système nerveux central et périphérique et nous hébergeons actuellement environ 30 lignées transgéniques et mutantes.

Nous suivons les premières étapes de la neurotoxicité visible dès deux jours de développement chez le poisson-zèbre. L’atteinte neuronale peut ainsi être suivie directement à l’échelle de la cellule et de l’organisme, avec notamment l’analyse comportementale avec la plateforme de phénotypage ZebraSens. Nos modèles nous permettent de tester des protéines candidates ou des composés à visée thérapeutique.
Cette plateforme accessible à la communauté scientifique a permis de développer en collaboration différents projets :
D’autre part, cette plateforme est impliquée dans la validation fonctionnelle pour des agents à visée thérapeutique dans des thématiques variées :
Nous assurons l’encadrement d’étudiant(e)s (Master Bio-Santé/Biotin M1, M2, Master EPHE), ingénieur(e)s, doctorant(e)s, post-doctorant(e)s et chercheur(e)s pour les techniques de microinjection à différents stades, pour la manipulation d’embryons et larves pour l’imagerie. Par ailleurs, tous les utilisateurs sont formés aux bonnes pratiques d’utilisation du modèle (zootechnie, expérimentation, réglementation).
 |
 |
|
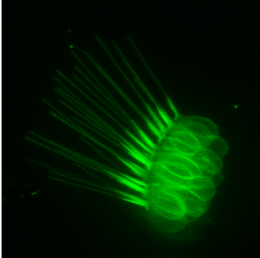
Cellules ciliées de l’oreille (cristae), lignée Brn3c-GFP, une atteinte de cette structure peut conduire à des défauts d’équilibre et d’audition |
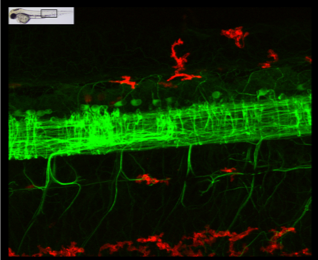
Protéine Tau humaine exprimée dans le système nerveux (vert) en interaction avec la microglie (rouge) |
 |
Maître de conférences, EPHE Contact : mireille.rossel(at)umontpellier.fr / mireille.rossel(at)ephe.sorbonne.fr Téléphone : 04 67 14 38 15 |
 |
Assistant ingénieur Inserm Contact : nicolas.cubedo(at)umontpellier.fr Téléphone : 04 67 14 38 15 |
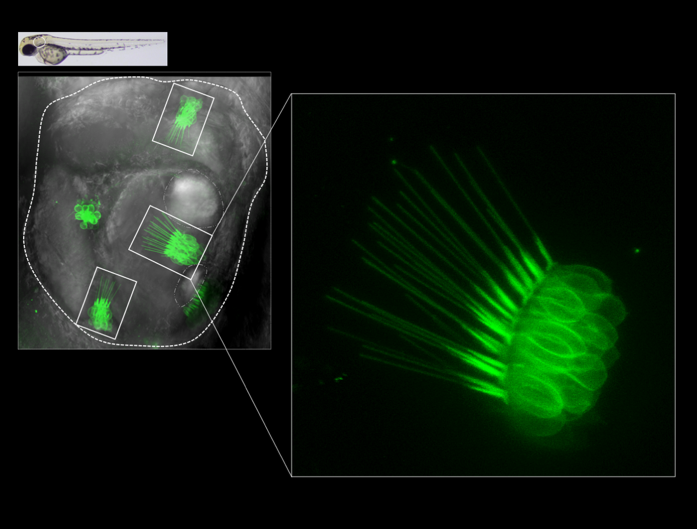
Cellules ciliées de l’oreille de larve de poisson-zèbre, marquées par la protéine fluorescente verte GFP. L’oreille est délimitée par les pointillés blancs et contient 3 groupes visibles de cellules ciliées, les cristas (encadrés blancs), dont les longs cils sont caractéristiques. Un agrandissement d’un des groupes montre la structure de ces cellules. Une atteinte de cette structure peut conduire à des défauts d’équilibre et d’audition.

Responsables scientifiques: Mireille Rossel et Benjamin Delprat
Responsable technique: Jérôme Sarniguet
Comité de pilotage : Anne-Françoise Roux, Mireille Rossel, Laurent Givalois, Tangui Maurice, Benjamin Delprat, Nadine Mestre-Frances, Jérôme Sarniguet
Le plateau ZebraSens a été créée à l’initiative de 2 laboratoires : MMDN (JM Verdier) et LGMR (AF Roux) afin d’analyser au niveau fonctionnel les déficits sensoriels et comportementaux dans les pathologies dégénératives.
Ce plateau regroupe sur le même site et à proximité du plateau d’élevage du Laboratoire MMDN « Ze-Neuro », des équipements de pointe permettant l’analyse de la vision, de l’audition et du comportement locomoteur du poisson zèbre aux stades larvaires jusque chez l’adulte, à savoir :
Depuis mars 2022, le plateau Zebrasens fait partie de la plateforme ZEFIX, plateforme technologique spécialisée dans les modèles aquatiques zebrafish et xénopes intégrée à l’UAR Biocampus Montpellier. ZEIX est une structure multi-sites qui regroupe 4 plateaux techniques d’élevage et d’expérimentation sur Montpellier. Son objectif est de fournir les espaces, les équipements, les expertises et les formations nécessaires pour l’hébergement et la mise en œuvre de projets en lien avec les modèles aquatiques Danio rerio (zebrafish) et Xenopus laevis (xenopes).
EQUIPEMENTS DISPONIBLES SUR LE PLATEAU:
- La Visiobox® permet d'évaluer la vision en mesurant la réponse OKR (OptoKinetic Response test). Ce test évalue l’acuité visuelle des poissons zèbre dans un environnement sans stress et de façon automatisée.
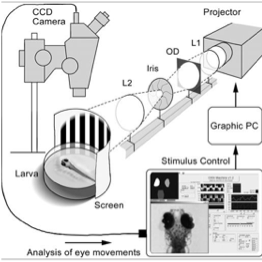


L’acuité visuelle mesurée par OKR implique le mouvement des yeux des poissons. Ce mouvement est généré par le défilement de lignes blanches et noires à intervalles réguliers et fortement contrastées. Il est possible de diminuer la taille, le contraste et la couleur des bandes pour augmenter la difficulté et évaluer avec précision l’acuité visuelle d’un poisson sauvage ou mutant. Il est possible de mesurer l’acuité visuelle de 4 poissons simultanément.
- Le ZebraCube® permet d’étudier l’activité locomotrice tridimentionnelle (XYZ) des poissons adultes. Les poissons sont vidéotraqués et il est ainsi possible de déterminer la distance parcourue, les phases d’arrêt et d’activité des poissons, la position des poissons dans les bacs. En outre, il est possible de mesurer le comportement social (« shoaling ») ainsi que la mémoire spatiale (T-maze et double H-maze) et le mémoire spatiale avec reconnaissance de pattern et stimulus externes (Y-maze).



- La Zebrabox High Speed® permet de mesurer l’acuité auditive des larves à partir de 5 dpf. Cette box dispose d’un module vibratoire ainsi que d’une caméra haute résolution (1000 images/sec). Ce système est ainsi capable de mesurer la courbure que fait la larve suite à une stimulation sonore de fréquence et d’intensité choisie. Cette courbure est caractéristique du comportement d’évitement d’un prédateur et renseigne sur l’acuité auditive du poisson.

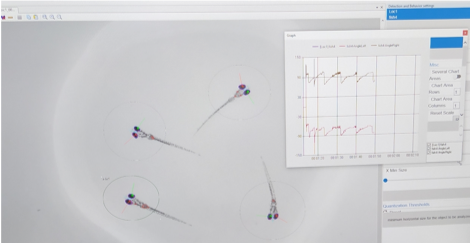
- Les Zebrabox® sont capables de mesurer l’activité locomotrice des larves à partir de 5dpf (tracking) ainsi que leur mobilité (quantification). Le test VMR (Visual Motor Response) permet de mesurer cette activité locomotrice en réponse à des changements brusques d’intensité lumineuse, isolés ou répétés. Les larves sont vidéotraquées et il est ainsi possible de déterminer la distance parcourue, les phases d’arrêt et d’activité des larves, leur position dans le puits.


Le test ASR (Acoustic Startle Response) permet de déterminer l’acuité auditive des larves en réponse à un stimulus sonore de fréquence et d’intensité choisie.
NB: une ZEBRABOX équipée avec 1 caméra haute vitesse 140 fps permet de suivre des mouvements rapides tels que des mouvements épileptiques
A noter : La Zebrabox® et le Zebracube® peuvent être utilisés également pour suivre l’activité locomotrice du modèle drosophile.
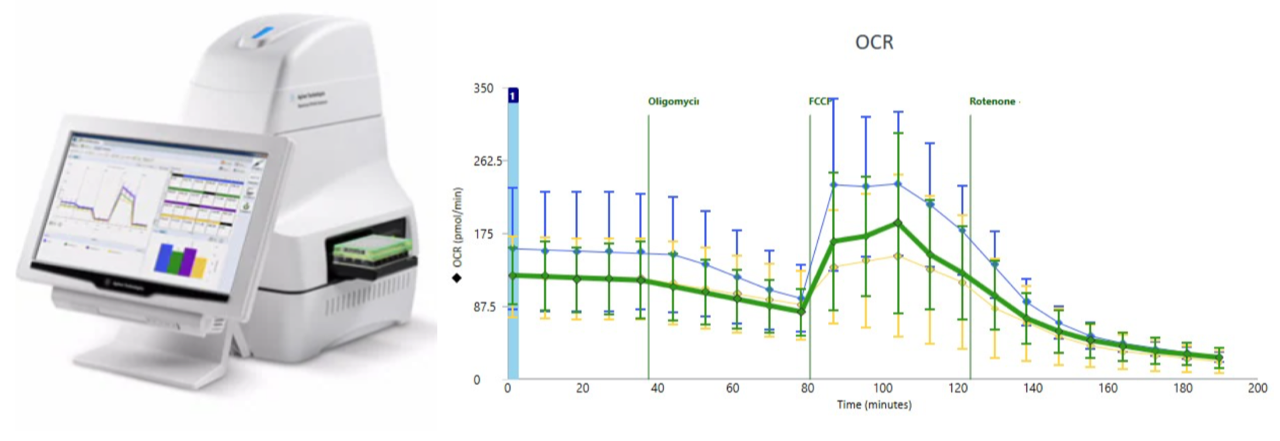
Le Seahorse XFe24 : permet la mesure du taux de consommation d'oxygène (OCR) des larves vivantes dans un format de plaque de 24 puits. Le taux d'OCR est un indicateur clé de la respiration mitochondriale et de la glycolyse ainsi que du taux de production d'ATP.
Tarifs sur demande : jerome.sarniguet(at)inserm.fr
Remerciements : La plateforme "ZebraSens de phénotypage" a été principalement financée par l’Association SOS Rétinite France, via le concours de la Caisse d’Epargne.

 |
Maître de conférences, EPHE Contact : mireille.rossel(at)umontpellier.fr / mireille.rossel(at)ephe.sorbonne.fr Téléphone : 04 67 14 38 15 |
 |
Chargé de recherche, Inserm Contact : benjamin.delprat(at)inserm.fr Téléphone : 04 67 14 36 23 |
 |
Ingénieur d'études, Inserm Contact : jérome.sarniguet(at)inserm.fr Phone : 04 67 14 38 15 |